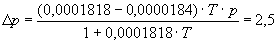 Torr
TorrDer Methode zur Bestimmung der molaren Masse nach Dumas liegt die allgemeine Zustandsgleichung idealer Gase zugrunde. Ein ideales Gas ist im Prinzip nur eine Modellvorstellung für theoretische Untersuchungen über das Verhalten von Gasen. Vor allem wird das Eigenvolumen der Moleküle, sowie alle Wechselwirkungen außer elastischen Stößen zwischen ihnen vernachlässigt. Nur auf diese Weise erfüllt ein Gas die erwähnte Zustandsgleichung
pV = nRT
R=8,3143 J K mol-1 : Gaskonstante, p: Druck, T: Temperatur, V: Volumen des Gases, n: Stoffmenge des Gases in Mol. Ersetzt man die Stoffmenge n = m/M, so kommt man auf die Formel
M = mRT/pV
mit der man die molare Masse bestimmen kann. Bei der Methode von Dumas werden von diesen Versuchsvariablen V, p und T durch die Umgebungsbedingungen gegeben. Die Eigenschaften realer Gase nähern sich denen eines idealen Gases um so mehr an, je geringer der Druck und je höher die Temperatur ist, also d.h. je weiter die Bedingungen des Gases von seinem Kondensationspunkt entfernt sind.
Um nun die molare Masse von Chloroform zu bestimmen, wird ein wenig Chloroform in einen Glaskolben gesogen, der dann in einem Wasserbad erhitzt wird, bis das Chloroform bei der Temperatur T und dem Druck p verdampft. Um T möglichst genau zu bestimmen, wird für den vorherrschenden Druck die Siedetemperatur des Wassers ermittelt, welcher auch dann zugleich die Temperatur des Chloroforms im Kolben ist. Damit das Eindringen von fremden Gasen verhindert wird, befindet sich das Ende der Kolbenkapillare in flüssigem Chloroform. Die Kapillare wird abgeschmolzen, sobald der Kolben nur noch gasförmiges Chloroform enthält. Die Masse wird somit durch Wägung bestimmt, während man das Volumen erhält, indem man den Kolben mit Wasser füllt und ihn dann abermals wiegt.
Zuerst wurden die Umgebungsbedingungen, d.h. der barometrische Druck und die Raumtemperatur festgehalten:
p’ = (727,5 ± 0,5) Torr
T = 21,0 °C ± 0,1 °C = 294,0K ± 0,1K
Da das Barometer auf 0° C geeicht ist, muß der Druck um einen Faktor korrigiert werden.
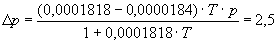 Torr
Torr
p = p’ - Dp= 725 ± 0,5 Torr = 96660 ± Pa.
Der korrigierte Siedepunkt von Wasser bei diesem Druck ist aus der Tabelle entnommen
Ts = 98,685 °C = 371,84 K
Um die molare Masse des Chloroforms zu bestimmen, wurden folgende Massen des gefüllten Glaskolbens gemessen:
mLuft = mL = 17,557 ± 0,001 g
mHCCl3 = mC = 17,822 ± 0,001 g
mH2O = mW = 117,267 ± 0,001 g
Wir fassten alles zu einer Formel zusammen:
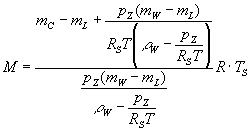 = 116 ± 1
= 116 ± 1
Da
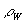 >>
>>
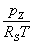 ist, kann der Fehler dieses Terms vernachlässigt werden.
ist, kann der Fehler dieses Terms vernachlässigt werden.
Nach partieller Differenzierung nach mC, mL, mW, pZ, T und Anwendung der Formel 7 (ABW Seite 10) des Skripts kommt man auf den obengenanten Fehler.
Nicht berücksichtigen konnten wir die etwaigen auftretenden systematischen Fehler bei der Gewichtsmessung, sowie beim Abschneiden des Glasröhrchens wegfallende Splitter.
Den restlichen Fehler kann man dadurch erklären.